Az endokrinológiai gyakorlat során a hallgatók tanulmányozzák a főbb hormontermelő szervek elhelyezkedését és működését. Az alábbiakban ezek rövid, vázlatszerű ismertetése következik.
A. Kis sejtekben:
Releasing és inhibiting hormonok termelése
LHRH (GnRH) FSH és LH serkentése
GRH (growth hormon releasing hormone) Növekedési hormon serkentése
Szomatosztatin Növekedési hormon gátlása, TRH hatásának gátlása
TRH (tireotrop releasing hormone) TSH szint fokozása
PRH (prolactin releasing hormone) Prolaktin szabályozása
CRH (corticotrop releasing hormone) ACTH termelés serkentése
Dopamin (PIH) Neurotranszmitter, Prolaktin szekréció gátlása
B. Nagy sejtekben:
Arginin-vazopresszin (AVP) és oxytocin (OT) termelése.
Részei: Adenohipofízís (AHF), Neurohipofízis (NHF) és hipofízis nyél.
Képződés: AHF a garathámból (Rathke-tasak), a NHF a III. agykamra fenekének az ektodermájából.
Nyél szerkezete: belül infundibulum (NHF), kívül pars tuberális (AHF)
AHF szerkezete: sokszögű sejtek - szinuszoidok
AHF hormonjai:
STH (növekedési hormon) Növekedés serkentése (szomatomedineken keresztül)
ACTH (adrenocorticotrop hormon) Mellékvesekéreg hormontermelését és vérátáramlását fokozza, továbbá lipolitikus és melanocyta stimuláló (kétéltűekben és hüllőkben) hatású.
TSH (Tireoideastimuláló hormon, tirotropin) Pajzsmirigy működését fokozza
FSH (Follikulus stimuláló hormon) Nőkben: petesejtérést fokozza Férfiakban: hímivarsejt termelése nő
LH (Luteinizáló hormon) Nőkben: tüsző érés fokozása, tüszőrepedés, sárgatest kialakulása Férfiakban: tesztoszteron termelés serkentése
LTH, Prolaktin Tejelválasztás fokozása, emlőnövekedés, gondozó magatartás, ovuláció gátlás.
MSH (Melanocyta stimuláló hormon, intermedin) Hidegvérűekben bőrszín változás befolyásolása.
Endorfinok (alfa,béta,gamma) Fájdalomcsillapítás
NHF hormonjai:
Arginin-vazopresszin (nucl. supraopticusból)
Hatás: Vízvisszaszívás, vérnyomás fokozása, memória serkentése
Oxytocin (nucl. paraventriculárisból)
Hatás: Tejelválasztás, méh izomzat összehúzódása.
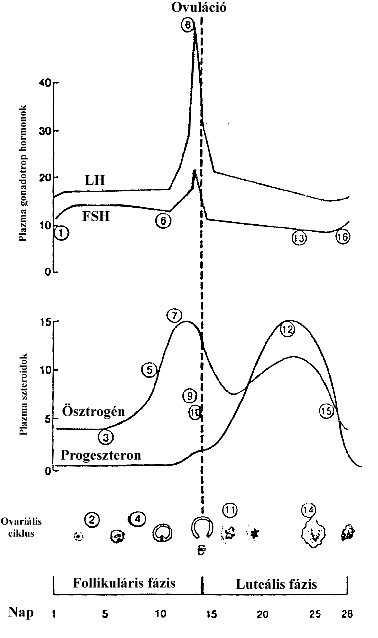
1. FSH és LH szekréció fokozott (mert a plazma ösztrogén szint alacsony, negatív visszacsatolás)
2. Follikulusok ösztrogén termelése megindul.
3. Plazma ösztrogén szint lassan növekszik.
4. Az egyik follikulus marad csak meg (ok ?), és ez az egy nagy mennyiségű ösztrogént termel.
5. Plazma ösztrogén szint markánsan emelkedik.
6. FSH és LH szekréció csökken – negatív visszacsatolás.
7. A növekvő plazma ösztrogén szint egy bizonyos érték fölött már serkenti az LH és FSH termelést. Pozitív visszacsatolás
8. LH csúcs kialakulása
9. Oocyta átesik az első meiotikus osztódáson - kevesebb ösztrogént termel – negatív visszacsatolás.
10. ovuláció
11. A sárgatest kialakul, progeszteron és ösztrogén termelés újra indul.
12. Plazma ösztrogén és progeszteron termelés fokozott, de nem annyira, hogy újabb pozitív visszacsatolást tudjon kiváltani.
13. FSH és LH szekréció gátlódik, plazmaszintjük leesik.
14. A sárgatest visszafejlődik és így csökken a hormon termelése.
15. Plazma ösztrogén és progeszteron szintje csökken, a negatív visszacsatolás megszűnik, így az
16. FSH és LH elválasztás megint fokozódik - új ciklus kezdődik.
Szerkezet: Glikoprotein (galaktóz+hexózamin), α és β alegységből áll, nem faj specifikus - terhességi teszt lehetséges.
Termelődés helye: Syncytiotrophoblast (placenta), magzati máj és vese
Termelődés ideje: Terhesség 6. napjától kimutatható a vérben. Vizeletben a csúcs:14-44 nap között.
Hatás: Luteinizáló és luteotrop hatású. Fokozza a corpus luteum progeszteron termelését. Kicsi FSH aktivitás - Galli-Mainini reakció alapja
Termelődés: POMC (proopiomelanocortin) - (ACTH, MSH, endorfin)
α MSH : ACTH első 13 aminosava
β MSH: γLPH C-terminális első 7 aminosava és az ACTH 4-10 aminosava
γ MSH: Középső lebenyben termelődik
Reflexes folyamat - Receptorok a szemben vannak.
Sötétben az MSH termelés nő.
Kétéltűek, hüllők, halak melanofor sejtjeiben (MF), melanin szemcsék formájában van jelen (emlősökben melanocyták vannak).
A melanin szemcsék típusai:
a. Eumelaninok: fekete, barna pigment
b. Feomelaninok: sárga, vörös (több szulfát csoportot tartalmaznak).
A melaninok a melanoszómáknak nevezett sejtorganellumokban képződnek.
A melanofor sejtek körül találhatók az iridofor sejtek (IF).
Az IF sejtek un. visszatükröződő korongokat (VK) tartalmaznak. Ha világos az állat, a melanofor sejtekben a melanin szemcsék a mag körül, az iridofor sejtekben a visszatükröződő korongok a sejt szélein vannak. Ha sötét az állat, a melanofor sejtekben a melanin szemcsék szétoszlanak, az iridofor sejtekben a visszatükröződő korongok aggregálódnak.
Külső és belsőelválasztású mirigy.
Fő feladat: emésztés, vércukor szint szabályozása.
Termelt hormonok:
Külső elválasztás:
Hasnyál Fehérje-, szénhidrát- és zsíremésztés.
Endokrin működés:
Inzulin (B sejtek) Serkenti a glükóz és a zsírsavak raktározását (Anabolikus hatás).
Glukagon (A sejtek) Raktárakból mobilizálja a glükózt és a zsírsavakat. (Katabolikus hatás).
Szomatosztatin (D sejtek) Szigetsejtek szekréciós tevékenységének szabályozása. Gátolja az inzulin és a pancreas polipeptid termelését
Pancreas Polipeptid (F sejtek)?.
Tiroxin, Trijodtironin, Alapanyagcsere, anyagcsere intenzitás szabályozása, növekedés, szellemi fejlődés serkentése.
Kalcitonin: Ca2+ szint szabályozása, felülről.
Renin, Erythropoetin: Vvt képződés stimulálása a vesén átáramló vér hipoxiája esetén.
Termelődés helye: Juxtaglomeruláris apparátus.
Fő hatás: Angiotenzinen keresztül a vérnyomás emelése.
I Kéreg;
Mineralokortikoidok:
Aldoszteron, Dezoxikortikoszteron Na+ szint szabályozása (és ezzel párhuzamosan a K+).
Glükokortikoidok:
Kortizol, Kortikoszteron Szénhidrátanyagcsere szabályozása, gyulladás és immungátlás.
Szexszuál szteroidok :
Dehidroepiandoszteron, Androsztendíon, Ösztrogének Másodlagos nemi jellegek kialakítása.
II VeIő:
Adrenalin, Noradrenalin Vércukorszint, vérnyomás, izom vérátáramlás emelése (Cannon-f. vészreakció)
Szomatomedinek – növekedés serkentése
Eritropoetinogén A vese által termelt eritrogenin enzim bontja - a képződő eritropoetin serkenti a vörösvérsejt képződést.
1. Ösztrogén - follikulusok Női másoglagos nemi jellegek kialakítása.
Méhre gyakorolt hatások: izomzat nő, OT iránti érzékenység nő. Menstruációs ciklus fenntartása.
Sárgatest Ösztrogén LH és FSH termelés gátlása.
Progeszteron Méhnyak és hüvely ciklikus változásaiért felelős. Gátolja az LH szekréciót.
Relaxin Sárgatestben és a placentában termelődik. Symphysist és az egyéb medencei ízületeket ellazítja - megkönnyíti a szülést.
Tesztoszteron - Leydig sejtek Férfi másodlagos nemi jellegek kialakítása. LH szekréció gátlása. Gametogenetikus működés fenntartása.
Inhibin - Sertoli sejtekbenFSH szekréció gátlása.
Pitvari nátriuretikus peptid (ANP) - Na kiválasztását fokozza - vérnyomás és só-vízháztartás szabályozása.
Szekretin
Pankreász víz és elektrolit elválasztásának serkentése. Gyomor sósavelválasztásának gátlása, pepszinelválasztás fokozása. A jejunum is termeli.
Kolecisztokinin pankreozimin (CCK-PZ)
Jejunum is termeli. Pankreász enzimelválasztásának fokozása, epehólyag kiürítése.
Értágító bélpeptid (VIP)
Hatása a szekretin és glukagon hatásához hasonlít. Simaizom lazítás - bélmotilitás csökkentés és vazodilatáció.
Gyomorgátló peptid (GIP)
glükóz függő. Gyomor sósavelválasztását csökkenti. Pankreász inzulin elválasztását serkenti.
Szerotonin (5-hidroxi-triptamin, 5-HT)
Érösszehúzó, bél motilitását serkenti, de a gyomrot és vastagbelet ellazítja. Idegi átvivő anyag is
Substance-P
Myentericus reflex kémiai mediátora. Vazodilatáció
Enterogasztron
Gyomorsav szekréció és motilitás gátló.
Neurotenzin
Hatás: ?
1. Vazopresszin (Sigma)1000 µg/ml - 0.3 ml/állat
2. Choriogonin (HCG) (Richter Gedeon)1500 NE/ 2 ml fiz.só 1 ml/állat s.c.
3. Glanduitrin (Richter Gedeon)Ampulla, 1 ml/10 NE
4. Exacthin (Kőbányai Gyógyszerárugyár)Ampulla, 1ml/40 NE
5. Giemsa-oldat (metilénazúr eozin) (Finomvegyszer Szöv.)
6. Etanol (Reanal) 96%-os
7. Éter
8. Uretán (Reanal)
9. Penicillin (Biogal)
10. Béka Ringer
11. Orto-toluidin-reagens
12. Triklór-ecetsav (Reanal)
13. Nembutal (CEVA)
14. Inzulin
15. Adrenalin (Tonogén, Richter Gedeon)
16. Glükóz (Reanal) 17. NaCl (Reanal)
1. Felhasznált állatok: Wistar hím és nőstény patkány, Rana esculenta var. ridibunda
2. bonckészlet
3. papírvatta, vatta
4. patkánypad
5. tus
6. 2 ml-s fecskendők
7. fecskendő tűk
8. csontvágó olló
9. mikroszkóp
10. sztereómikroszkóp
11. sebvarró cérna
12. tárgylemezek
13. fülpiszkáló
14. exszikátor
15. fogászati fúró
16. érszorító csipesz
17. vízlégszivattyú
18. mérleg
19.100 ml üvegpohár
20. sebvarró tű
21. tűfogó
22. üvegkád 2 db
23. patkány doboz
24. Pasteur pipetta
25. szemcseppentő
26. Wasserman cső
27. vízfürdő
28. centrifuga
29. automata pipetta
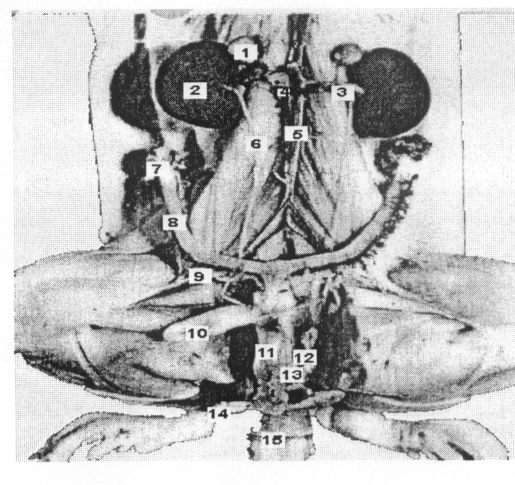
1. Mellékvese 2. vese 3. Vese art. és véna 4. v. cava inf. 5. a. mesenterica 6. ureter 7. petefészek 8. méh 9. mesometrium 10. húgyhólyag 11. húgycső 12. medenceöv 13. hüvely 14. fityma mirigy 15. vulva
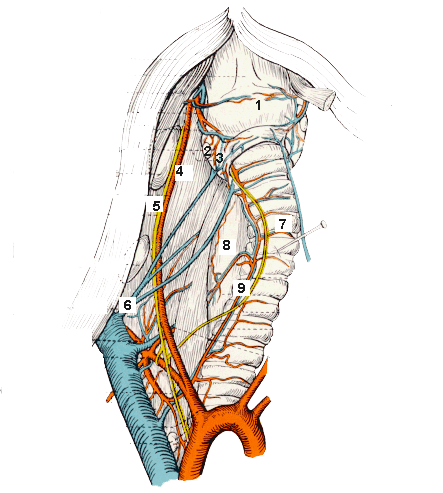
1. gége 2. mellékpajzsmirigy 3. pajzsmirigy 4. a. carotis communis 5. n. vagus 6. v. jugularis 7. trachea 8. nyelőcső 9. pajzsmirigy artéria és véna
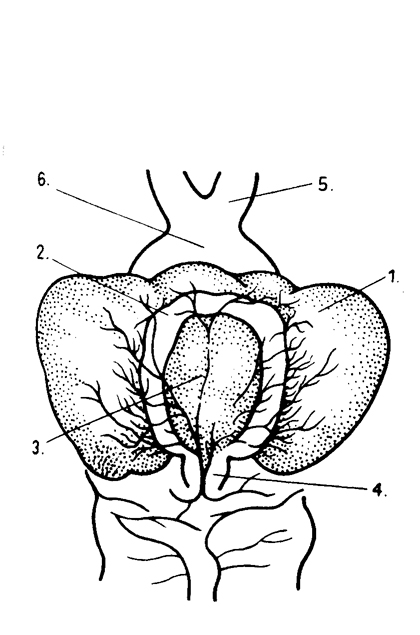
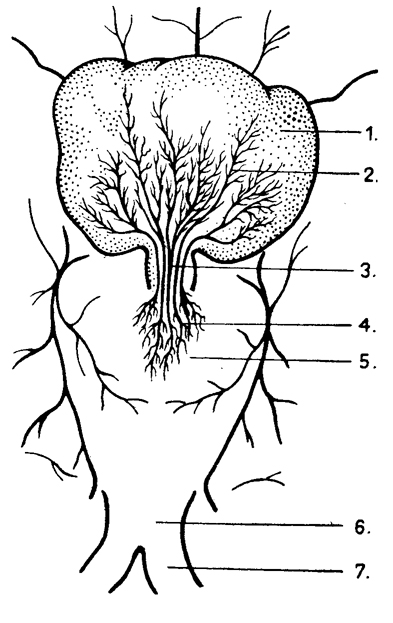
A hipofízis patkányban három jól elkülönülő részből áll: elülső és közti lebeny (adenohipofízis) és hátulsó lebeny (neurohipofízis). A hipofízis a nyélen (infundibulum) keresztül kapcsolódik a hipotalamuszhoz. A hipotalamusz agyalap felőli részén jól elkülönül a chiasma opticum, az eminentia mediana és a corpus mamillare. A hipofízis nyelén keresztül haladnak azok a portális erek, amelyek az eminentia mediana területén a primer kapillárisokból (ezek tulajdonképpen az a. carotis intema mellékágaiból erednek) szedődnek össze (primer plexus) és az adenohipofízis szövetében mint szekunder kapilláris rendszer elágaznak. A kapillárisok a portális vénatörzsekben egyesülnek. A szinuszoidokban így kevert vér található. Az adenohipofízis az a. hypophyseos anteriorból közvetlenül is kap artériás vért. A portális rendszer egyszerű tusmódszer alkalmazásával jól megfigyelhető.
A vizsgálatra nagyobb, 250-300 g-os Wistar patkányt választunk ki. Mély éternarkózisban megnyitjuk a mellüreget és a szív bal kamrájába 1,0-1,5 ml tust injiciálunk. A közönséges tus fenolt tartalmaz, ezért a patkány szívműködése már a tus injiciálása közben megszűnik (A különböző tus festékek nem egyforma fenol tartalmúak). A tus bejutása a megfeketedő fülön, szemen, orron jól ellenőrizhető. A fejet levágjuk, a bőrt eltávolítjuk. Erős csontvágó ollót az öreglyukba (foramen occipitale) vezetve a koponyát a suturák mentén a jobb, majd a bal oldalon felvágjuk. A preparálást a nyak felöli oldalon kezdjük. A kilépő idegeket elvágjuk, s az agyat óvatosan kezdjük kihajlítani. Ha elértük a török nyeregben (sella turcica) elhelyezkedő hipofízist - amelyet egy erős kötőszöveti tok vesz körül -, a csontról a diaphragma sellaet hegyes, finom csipesszel vagy bonctűvel lefejtjük, úgy, hogy a hipofízis nyele ne szakadjon el. A preparálást megnehezíti, hogy a tusszemcsék miatt a tájékozódás igen nehéz. A koponyát időnként folyóvízzel lemossuk. A preparátumot sztereomikroszkóp alatt vizsgáljuk. Először 1,6X majd 4X nagyításon.
A portális érrendszer megfigyeléséhez természetesen el kell távolítani a dura maternek az agyalapot borító részét is. Ezt igen finom, hegyes végű csipesszel és ollóval végezzük lupe alatt. A kötőszöveti hártya eltávolítása után láthatóvá válik a hipofízis nyele, a benne futó portális érrendszer, a primer és szekunder kapillárishálózat. A hipofízist, nyelének elszakítása nélkül, előrehajtjuk, ekkor a dorzális felszínén szembetűnik az egészen fehér színű közti lebeny, amely körülfogja a tussal erősen telítődött hátulsó lebenyt. A portális érrendszernek döntő szerepe van a hipofízis normális működésében. Rajta keresztül jutnak az elülső lebenybe az ún. kioldó (releasing) és gátló (inhibiting) faktorok.
Patkány hipofízis dorzális felszíne. 1.pars distalis (adenohipofízis); 2. pars intermedia; 3. pars nervosa (neurohípofízis); 4. infundibulum; 5. n. opticus; 6. chiasma opticum
Patkányhipofízis portális érrendszere. 1. adenohipofízis; 2. szekunder kapillárisok; 3. hosszú portális erek; 4. primer kapillárisok; 5. eminentia mediana; 6. chiasma opticum; 7. n.opticus
Az ADH fokozza a béka bőrén keresztül történő vízfelvételt.
A kísérlet során két békát használunk. Mindegyiket szárazra töröljük és 0.1 g pontossággal lemérjük. Az egyik békának intraperitoneálisan (i.p.) ADH-t (0.3 ml vazopresszin, 30 µg/állat), a másiknak 0.3 ml Ringer oldatot adunk. Az állatokat vízzel teli kádba helyezzük. 1 és 2 óra múlva a békákat újból szárazra töröljük és lemérjük a súlyukat. AVP kezelés hatására a béka testtömege nőni fog.
Hipofízis irtás
Felnőtt béka hátára egy kevés uretánt szórunk. Ettől néhány perc alatt elalszik. Az elaltatott békát háttal a békapadra fektetjük, az alsó állkapcsot kinyitjuk és érfogó csipesszel rögzítjük. A felső szájpadlás nyálkahártyáján egy kis bemetszést ejtünk a kereszt alakú os parasphenoideum fölött. A vékony és áttetsző csont középpontja alatt helyezkedik el a rózsaszínű hipofízis, amelynek körvonalai jól láthatók. A csontot a hipofízis fölött óvatosan fogászati fúróval átfúrjuk, a hipofízist vízlégszivattyú segítségével eltávolítjuk. A sebet ezután sebvarró cérnával zárjuk. A békát megmossuk (a felesleges uretánt így eltávolítjuk). Az állatot előbb világos helyre, majd később sötét környezetbe rakjuk. Megfigyeljük, hogy a béka színe hogyan változott a kontroll állatéhoz képest.
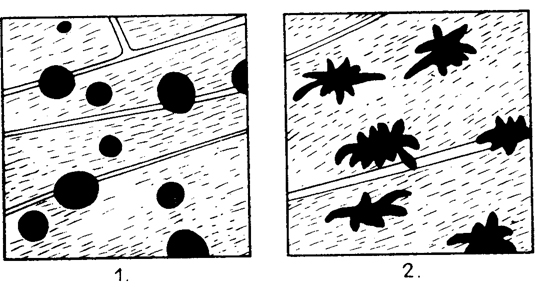
Az MSH hatása nemcsak hipofizektomizált, hanem intakt békán is tanulmányozható. Rana esculenta fajhoz tartozó békákat üvegkádban fehér alapra helyezzük és megvilágítjuk. A békák színe 1-2 nap alatt jelentős mértékben kivilágosodik. Ekkor binokuláris sztereomikroszkóp alatt (kb. 50-szeres nagyítás), a hátulsó végtag úszóhártyáján megvizsgáljuk a kontrahált állapotban levő melanoforákat. Ezek nagy, kerek vagy ellipszis alakú fekete pontok alakjában tűnnek elő. A békák felének 0,5-1 NE Glanduitrin-preparátumot vagy 10NE Exacthint injiciálunk a hasüregbe és továbbra is a megvilágított helyen hagyjuk. A kezelt állatok már fél óra múlva észrevehetően sötétednek. A melanoforák kezdenek elernyedni, ami a további sztereomikroszkópos vizsgálattal jól figyelemmel kísérhető. A kezelt békák 1-2 napig megtartják sötét színüket, majd ismét világosodni kezdenek
Békabőr melanoforáinak válasza hátsó-középső lebeny kivonat hatására. 1. kezelés előtt; 2, glanduitrin-kezelés után
A nőstény patkány ivarzása 5-8 naponként jelentkezik. Az ivari ciklusban négy fázis különböztethető meg; mindegyik fázisban jellegzetes változások mennek végbe az ovariumban, az uterusban és a vaginában. A hüvelyből vett kenet alapján megállapíthatjuk, hogy az állat az ivari ciklus melyik fázisában van. A ciklus csúcspontját az ösztrusz képezi (132. ábra, c; 10-18 óra), melynek elejére esik az ovuláció. Az ilyen fázisból származó hüvelykenetben elszarusodott, nem festődő magvú hámsejtek találhatók. Ezt követi a metösztrusz (132. ábra, d; 24-30 óra), a leépítési szakasz, amelyben elszarusodott hámsejtek, leukociták és hámsejtek figyelhetők meg. A következő fázis a diösztrusz (132. ábra, a; 50-60 óra), amelyre magvas hámsejtek, leukociták és nyálka jellemző. Utána az ösztrusz megelőző proösztrusz (132. ábra, b; 12 óra) következik, amelyben csak magvas hámsejtek találhatók. Az ivari ciklus fázisának meghatározása a következőképpen történik. Wistar patkánytól (a megfigyelést egéren is végezhetjük) fülpiszkálóval hüvelyváladékot veszünk és ezt tárgylemezre kenjük. A kenetet 96%-os alkohol és éter 1:9 arányú keverékével vagy láng felett fixáljuk és Giemsa oldattal (metilénazúr eozin) megfestjük. A megszűrt Giemsa-oldatot a kenetre cseppentjük és 3-5 percig rajta hagyjuk. Forró vízzel lemossuk, desztillált vízzel leöblítjük. A metilénazúr a fehérvérsejtek és hámsejtek magvait kékre, az eozin a hámsejteket rózsaszínűre festi. A leitatott kenetet mikroszkóp gyenge nagyításával vizsgáljuk. Állapítsuk meg, hogy a vizsgált állat az ösztrusz ciklus melyik fázisában van. Több állat megfigyelése esetén minden fázisra találunk példát.
9.9. ábra - Patkány hüvelyfal és hüvelykenet mikroszkópos képe az ösztrusz ciklus különböző fázisaiban
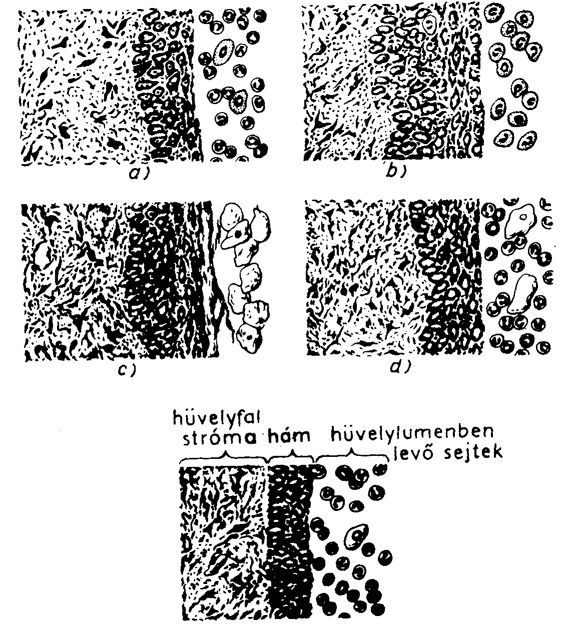
a-diösztrusz
b-proösztrusz
c-ösztrusz
d -metösztrusz
A GALLI és MAINlNI által a Xenopus laevisre kidolgozott terhességi reakciót BACH és SZMUK alkalmazták a kecskebékára (Rana esculenta). A kezelés előtt hím kecskebéka kloakájából Pasteur pipettával próbát veszünk, és mikroszkóp alatt megvizsgáljuk. Ha ebben a "vakpróbában" már találunk spontán ürített spermiumokat, akkor a béka egy időre a vizsgálatra alkalmatlan. Ha az alappróba spermiumokat nem mutatott, akkor a békatestsúly 10 %-ának megfelelő mennyiségű (2-3 ml) vizsgálandó vizeletet injíciálunk az egyik limfazsákba (vagy 1 ml choriogonint (HCG)) a has vagy a hát bőre alá; 3-4 óra múlva a béka kloakájából ismét néhány csepp vizeletet veszünk és mikroszkóp alatt vizsgáljuk (40 x-es nagyításon). Ha a HCG mennyisége a vizsgálandó vizeletben felszaporodott, akkor a béka vizeletében spermiumok jelennek meg. Ezek alakja az emberi spermiumokétól különbözik. A spermium feje hosszú, téglalap alakú; a farok natív készítményben nem vagy csak alig látszik. Jellemző a spermiumokra az élénk mozgás. A reakció megbízhatósága szempontjából fontos a hím béka pontos felismerése (hüvelypárna, hanghólyag). Nem szabad a spermiumokat a kloakában élő egysejtűekkel (csillós egysejtűek: Opalina ranarum, Balantidium sp.; amőba: Entamőba ranarum) összetéveszteni. A próbára két békát állítunk be. Ha közülük csak az egyik mutat spermiumürítést, a reakció akkor is pozitív.
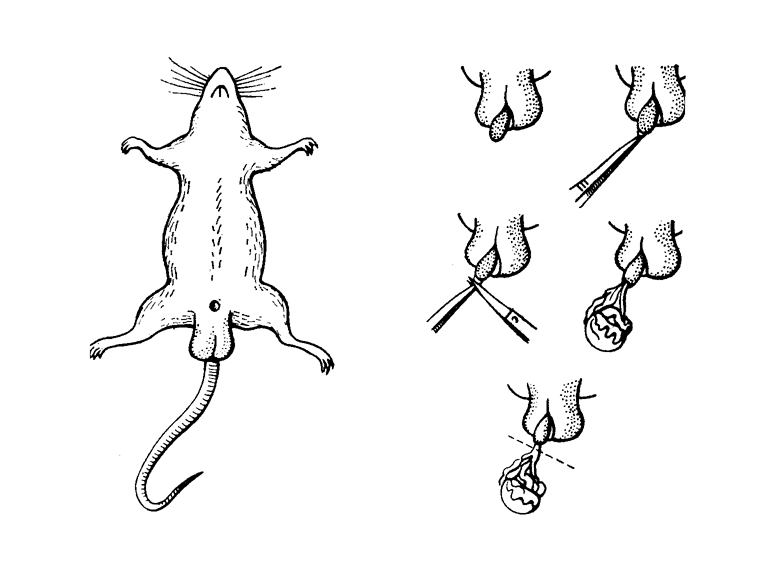
A műtétet éternarkózisban végezzük. A patkányt kb. 3 literes üvegbura alá tesszük, ugyancsak a bura alá vattacsomót helyezünk, melyre 4-5 ml étert öntünk, így kb. 7-8 térfogatszázalék lesz az éter koncentrációja a bura alatt, amely 3-4 perc múlva mély narkózist okoz. Az állat először szimatol, ágaskodik, majd menekülni próbál, végül oldalára fekve egyenletesen lélegzik. Ekkor kivesszük a bura alól és a műtőpadra erősítjük. A vattacsomót kis üvegpohárban a patkány fejéhez helyezzük. Állandóan ügyeljünk arra, hogy a légzés egyenletes legyen, és ha az állat szaruhártyájához nyúlunk (pl. ceruzaheggyel), a szemhéjak összezáródjanak. Ha ez a reakció nem jelentkezik, akkor nem szabad tovább étert adagolni. A kasztrációt a hasoldal felől végezzük. Az előzetesen szőrtelenített műtéti területet fertőtlenítjük: 5 %-os jódtinkturával kétszer bekenjük. Majd ollóval kb. 2 cm-es bevágást ejtünk. A vérzés csillapítása után a bőrsebet széthúzzuk, a hasfalat a linea alba mentén felvágjuk. Már most ügyeljünk arra, hogy a két seb ne azonos metszésvonatban legyen, hanem összevarráskor rétegesen fedje egymást. A zsírszövetet óvatosan széthúzva megkeressük a sárgás-piros színű petefészket. Amennyiben felkeresése nehézséget okoz, az uterusz mentén haladva könnyen megtalálhatjuk. Csipesszel a környezetéből kipreparáljuk, az uterusz végét fonállal lekötjük, majd a petevezetőt sértetlenül hagyva a petefészket kivágjuk. A sebbe az esetleges fertőzés elkerülésére penicillint szórunk. Vérzéscsillapítás után a sebet két rétegben összevarrjuk. Az operált állatot visszatesszük megszokott helyére. Adhatunk az állatnak azonnal enni és inni. Az öltések a gyógyulás után maguktól kiesnek.
A legkönnyebb műtétek közé tartozik. Az sem bonyolítja, hogy patkányban az ágyékcsatorna nem szűkül össze, ezért mindkét here visszahúzható a hasüregbe. Ha a hím patkányt kézbe fogjuk, szabadulni igyekszik, az erőkifejtéstől a két here visszacsúszik a herezacskóba és ott tapintható. Az éterrel narkotizált patkány herezacskójának középvonalában kb. 1 cm-es vágást ejtünk. Ujjunkkal a hasüregből kinyomjuk az egyik herét. A bőr alatt levő erős kötőszöveti hártyán (tunica vaginalis, 133. ábra) egy kis vágást ejtünk, és a herét a mellékherével együtt ezen keresztül kibuktatjuk. A here a nagyobb; jellegzetes, hullámos érrajzolata van. Az epididymisen szabad szemmel is jól látható a hajszálcsövek tömege. A funiculust lekötjük és disztálisan átvágjuk. Az artéria és a véna spermatica lekötése miatt vérzés egyáltalán nincs. A lekötött csonkot a herecsatornába visszatoljuk, a sebbe penicillint szórunk és a hártya kis nyílását körülöltjük. A másik oldali here eltávolítása után a bőrt varrjuk. Két héttel a műtét után boncoljunk fel egy kontroll és egy kasztrált állatot. Hasonlítsuk össze a járulékos nemi szerveket.
A vizsgálatra 3-400 g súlyú Wistar patkányokat használunk. A patkányokat a kísérlet előtt legalább félnapig éheztetjük. Az állatokat Nembutallal (45 mg/kg i.p.) elaltatjuk, majd az alvó állatok laterális farokvénájába injekciós tűt helyezünk (lásd VII.4.3.2. fejezet). A gyógyszertárban kapható inzulin injekcióból (200 NE/5 ml) fiziológiás NaCl oldattal 0.4 NE/ml-es oldatot készítünk. Ebből 0.25 ml-t (0.1NE) injiciálunk s.c. a hát bőre alá. Másik patkányon az inzulin antagonista adrenalin hatását vizsgáljuk. 0.0001 %-os adrenalin oldatot (Tonogén, 0.1 %-os adrenalin) készítünk, majd ebből 0.5 ml-t adunk be s.c. A harmadik állatnak inzulint és adrenalint egyaránt beadunk. A kezelések előtt és után 1 és 2 órával 100-100 µl vért veszünk a patkányoktól. A mintákat 1-1 ml 10 %-os triklór-ecetsavba pipettázzuk.
A Hultman-féle fotometriás cukormeghatározás alapelve: Orto-toluidin az aldóz típusú cukrokkal specifikus és nagy érzékenységű színreakciót ad, melynek abszorpciós maximuma 625 nm-nél van. Wassermann csövekbe 1 ml 6%-os triklór-ecetsavat, majd ebbe 0,1 ml vért többszöri átmosással bemérünk. Az elegyet 5000-es fordulatszámmal 10 percig centrifugáljuk, a felülúszót tiszta Wassermann csövekbe átöntjük. Kémcsőbe 3 ml orto-toluidin-reagenshez 0,5 ml felülúszót öntünk. A kémcsöveket laza papírdugóval bedugjuk és 8 percre 100 oC-os vízfürdőbe helyezzük. Ekkor kialakul a jellegzetes kékeszöld szín. Lehűtés után a mintákat 625 nm-nél fotometráljuk a vakpróbával szemben. Vakpróbaként 0,5 ml triklór-ecetsavat elegyítünk 5 ml reagenssel, a továbbiakban azonos módon kezeljük a vérmintákkal. Kalibrációs görbe felvétele 50-400 mg %-os glükózoldat 0,1 ml-jeinek triklór-ecetsavval és orto-toluidin-reagenssel való elegyítése és a fentebb leírt eljárás alkalmazásával történik.
Vércukormérés: kalibrációs görbe adatai
Vércukormérés: kísérleti eredmények